Материал по докладу VII Ежегодной конференции по БАС
Доклад Мерит Сюдкович, невролога, клинического исследователя, директора Sean M. Healey & AMG Center по БАС
Примерно 400 000 человек в мире болеет БАС. Это заболевание считалось редким, но исследования говорят, то оно достаточно распространено: 1 мужчина из 350 и 1 женщина из 440 в мире страдают БАС. Вероятно, количество больных в будущем будет только возрастать.
Сейчас в мире разрабатываются препараты для уменьшения прогрессирования заболевания и улучшения качества жизни пациентов. В настоящее время в США проходят клинические испытания 9 перспективных препаратов.
FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, Food and Drug Administration) уже одобрило Рилузол (Riluzole) и Эдаравон (Edaravone). Рилузол был одобрен еще в 1995 году. Он помогает увеличить выживаемость пациентов на 2−3 месяца, что было подтверждено несколькими исследованиями. Эдаравон был одобрен FDA в 2017 году для внутривенного введения, а мае 2022 г. для приема в таблетках. Было установлено, что Эдаравон уменьшает прогрессирование симптомов болезни на 20−30%. Мы надеемся, что таблетированная форма препарата также будет эффективна.
Третий препарат, применяемый в США при БАС, — Нудекста (Nuedexta). Это лекарство используется для коррекции псевдобульбарного синдрома (неконтролируемого смеха и плача). В дополнительных исследованиях также было показано, что Нудекста может влиять на бульбарный синдром (поражение ядер продолговатого мозга).
Сейчас проводится множество других исследований. Итак, более 250 компаний представило препараты для исследований. К сожалению, недавно завершенные исследования препаратов Levosimendin, Ultomiris, Zilucoplan, Arimoclomol не показали эффективности.
Наиболее перспективные препараты, исследования которых продолжаются, это Amylyx (АМХ0035), Метилкобаламин (Methylcobalamin), Тоферсен (Tofersen) и NurOwn.
Я хотела бы показать Вам результаты препарата Amylyx — это комбинация фенилбутирата натрия и тауроурсодеоксихолевой кислоты. Препарат влияет на оксидативный стресс и воздействует на клеточные механизмы. Вместе эти вещества дают больший эффект, чем в отдельности. Уже 137 пациентов с БАС приняли участие в исследовании под названием CENTAUR, часть из них прошли рандомизацию и были распределены в группу, получающую лекарство, а часть — в группу плацебо.
В исследование включали пациентов на ранней стадии БАС с быстрым прогрессированием, чтобы можно было получить результаты в течение 6 месяцев. Мы установили, что Amylyx на 25% замедляет прогрессирование БАС. Анализ выживаемости продолжится в открытом дополнительном исследовании (3 фаза под названием PHOENIX), которое позволит нам получить расширенные результаты и зарегистрировать препарат. 600 пациентов в течение 48 недель будут участвовать исследовании; дизайн этого исследования отличается от CENTAUR. Оно крупнее, будет идти дольше и критерии включения пациентов будут шире (жизненная емкость легких (ЖЭЛ) >55%, длительность заболевания не более 24 месяцев от начала заболевания). Около 1,5 лет потребуется для получения окончательных результатов.
Мы надеемся, что препарат будет одобрен до завершения исследования и станет доступен для пациентов.
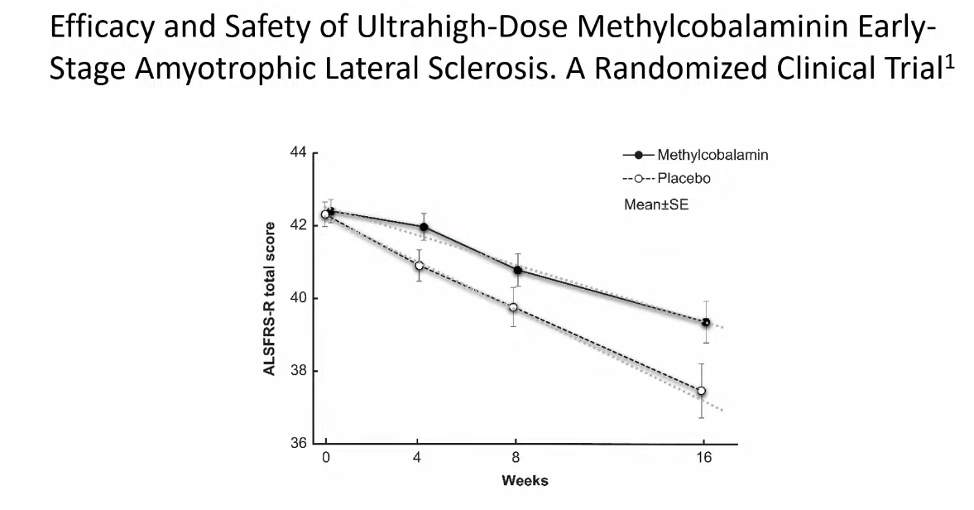
Я хочу также показать вам результаты исследования применения сверхвысоких доз Метилкобаламинина на ранних стадиях БАС, которые были опубликованы 9 мая 2022. На рисунке мы видим разницу прогрессирования болезни по оценке шкалы ALS-FRS-R на 60% по сравнению с группой пациентов, принимавших плацебо. Этот препарат планируют одобрить в Японии.
Ryosuke Oki et al for the Japan Early-Stage Trial of Ultrahigh-Dose methylocobalamin for ALS (JETALS) Colloborators Jama Neorology 2022 JAMA Neurol doi: 10.1001/jamaneurol.2022.0901 Published online May 9 2022
Следующий перспективный препарат NurOwn. Клеточная терапия от компании Brainstorm.
В 3 фазе исследования пациенты были распределены в соотношении 50:50 для двойного слепого рандомизированного исследования препарата NurOwn. В течение 28 недель исследователи оценивали состояние пациентов по функциональной шкале БАС. У пациентов, получавших NurOwn, заболевание прогрессировало медленнее в каждой точке нашего наблюдения, чем в группе плацебо. Но эта разница не была статистически значимой.
Однако лабораторные тесты показали положительный результат у пациентов в группе лечения: показатели маркеров нейровоспаления и нейродегенерации в спинномозговой жидкости уменьшались, а показатели факторов роста нервных клеток увеличивались.
Компания планирует продолжить исследование данного препарата.
Препарат Тоферсен — антисмысловой олигонуклетоид, направленный на супрессию гена SOD1. Мы обнаружили, что уровень экспрессии гена SOD1 в исследовании действительно снижался. Справа мы видим график лечения пациентов; коричневым цветом выделены пациенты, принимавшие Тоферсен, синим — группа плацебо.
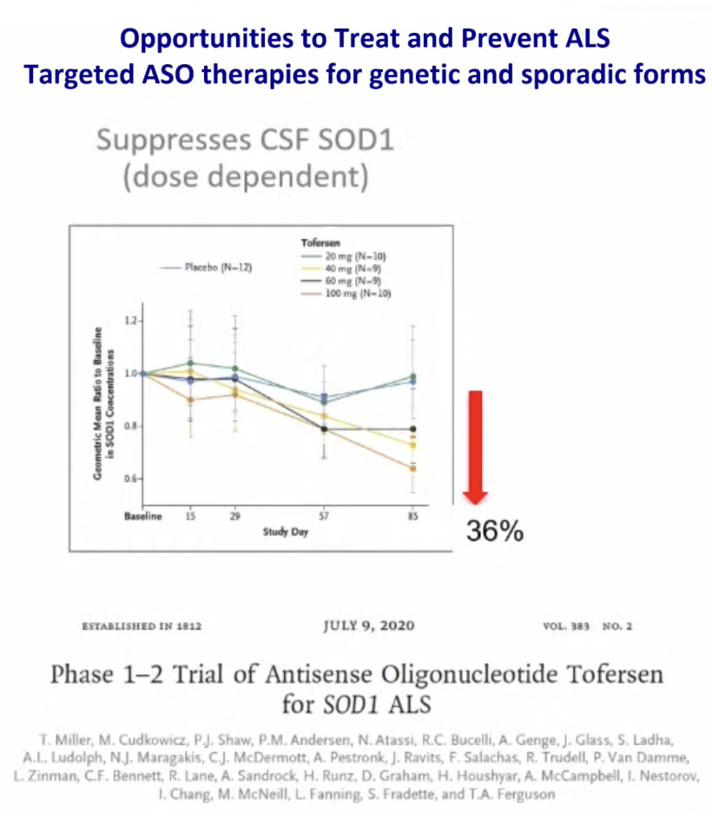
Исследование VALOR (3 фаза), к сожалению, не дало значимых положительных результатов. И все же мы увидели положительную динамику маркеров нейродегенерации.
Возможно, генной терапии требуется больше времени для проявления эффекта, так называемый «отложенный эффект». Еще одно наше опасение — это возможно быстрое ухудшение симптомов при быстром течении БАС.
Итак, мы сумели показать, что генная терапия снижает скорость прогрессирования симптомов и уровень гена SOD1 при раннем применении Тоферсена. Также мы отметили, что препарат действует на нейрофиламенты — маркер нейродегенерации. Мы обнаружили, что ни один другой препарат не оказывает такого воздействия на нейрофиламенты.
Важным шагом вперед стало следующее исследование! Это применение Тоферсена у пациентов до появления у симптомов, то есть превентивное лечение для носителей мутации SOD1.
Большое количество исследований проводятся по всему миру, и нам предлагают множество вариантов препаратов не только в США. И мы перешли к платформенному исследованию для того, чтобы собрать воедино все эти препараты и достичь максимального эффекта.
Мы решили применить подход, используемый в онкологии, когда для лечения пациентов используется множество препаратов одновременно, и создать «кросс-платформенное» исследование. Традиционный подход — исследование только одно препарата, может быть неэффективен из-за быстрого течения болезни. В платформенном исследовании можно совмещать несколько стратегий одновременно.
Мы запустили «кросс-платформенное» исследование в июне 2020 г. Большую поддержку оказал Шон М. Хили (Healey), пациент с БАС. Мы знаем, что платформенный подход сокращает время исследования наполовину, затраты на треть, а также позволяет уменьшить число пациентов в группе плацебо. И это один из способов победить время.
Мы начали с трех препаратов. Пациенты включаются в платформенное исследование, рандомизируются и получают препараты.
Пациенты не выбирают, какой препарат принимать. Рандомизация проходит в соотношении 3:1 в каждой группе, и только 25% участников находятся в группе плацебо. Преимущество платформенного подхода также в том, что группа плацебо едина для нескольких препаратов. И в конце исследования мы получаем результаты для всех трех препаратов. Первый из них — Зилукоплан (Zilucoplan).
Если бы появился новый препарат при традиционном подходе, то пришлось бы заново начинать исследование. В платформенном исследовании преимущество в том, что здесь мы смогли просто добавить новый препарат, в нашем примере — придопидин. А через пару месяцев мы добавили еще один препарат — трегалозу. Мы надеемся получить официальные результаты исследования в августе 2022 года, результаты по придопидину — в сентябре 2022 года, а по трегалозе результаты будут получены в мае 2023 года.
Это итоги большой общей работы. Мы все работали в большой связке — с FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, Food and Drug Administration), сообщество пациентов, фонды, исследователи и исследовательские центры.
Итак, как это работает? Есть общая платформа, в которую включена вся популяция пациентов. Составляется основной протокол, и мы можем наблюдать за разными исследованиями и анализировать, как долго будет проходить исследование. Для всех режимов лечения используется одна платформа, но есть также специфическая информация для каждого режима исследования, например, по безопасности, по характеристикам, по дозировке. И нам не нужно сильно изменять исследование, мы можем учитывать, например, параметр только безопасности.
У нас общая группа плацебо очень экономит время исследования. В Шотландии и вообще в Британии также начали пробовать такой подход совместного плацебо, и коллеги также запустили платформенное исследование. И сейчас этот подход становится очень популярным при БАС в мире, в области неврологии. В нашем платформенном исследовании мы начали со 160 пациентов, по 20 в группе препаратов, 40 в группе плацебо. Сейчас у нас 120 пациентов плацебо для всех групп лечения.
Через 36 месяцев мы начинаем открытое дополнительное исследование и смотрим на более широкие эффекты препарата, как это было с АМХ; также на качество жизни, выживаемость
Также наши конечные точки — это выживаемость и различные показатели (оценка по шкалам, ЖЭЛ, показатели динамометрии
В данный момент исследования проводятся только в США, в наших центрах, но мы также планируем расширять исследования на наши центры за пределами США. И очень важно в силу его сложности сделать это исследование комплексным, глобальным.
Мы обнаружили, что исследование было так популярно, что нам сложно отвечать всем пациентам, на все запросы. Поэтому мы решили создать центр общения с пациентами, Контактный центр, чтобы отвечать на все вопросы пациентов, чтобы пациенты могли найти наиболее удобный для них исследовательский центр. Мы также проводим еженедельные вебинары, на которых рассказываем людям о том, что происходит. Отвечаем на их вопросы об испытании.
И, так как я упоминала, что на первые четыре препарата закончен набор пациентов, и первые результаты исследования мы должны получить уже в августе-сентябре 2022. И это открытое рандомизированное исследование, которое будет сопровождаться последующими дополнительными исследованиями.
Я хочу сказать, что это действительно очень важное время для борьбы с БАС, и мы работаем не только над тем, как лечить болезнь, но и над тем, как проводить ее профилактику. У нас есть большая линейка препаратов, и все больше и больше препаратов добавляются в эти исследования. Инновационный и эффективный дизайн исследований также позволяет нам улучшать качество исследований. К тому же мы привлекаем сообщество пациентов, что позволяет нам быстрее проводить исследования.
Вероятно, нам понадобится «коктейль» из препаратов, то есть комплексный подход, сочетание разных препаратов. А также наша цель — это профилактика долгосрочных последствий БАС. Я хотела бы сказать о людях, с которыми мы работали, о той сети, которую мы создали, о различных центрах и фондах, которые мы задействовали в нашем исследовании. Большое спасибо!
Перевод: Елена и Тамара Агафонычевы.
Под ред. Демешонок В.С.