Каковы генетические факторы риска развития бокового амиотрофического склероза?

В настоящее время известно более 20 генов, мутации в которых связаны с развитием либо спорадической, либо семейной, либо обеих форм БАС. Как они влияют на развитие заболевания? Обобщить данные по этому вопросу попыталась группа ученых в своей работе «Факторы риска и методы лечения бокового амиотрофического склероза». Продолжаем цикл переводов материалом о генах, мутации в которых способствуют развитию заболевания.
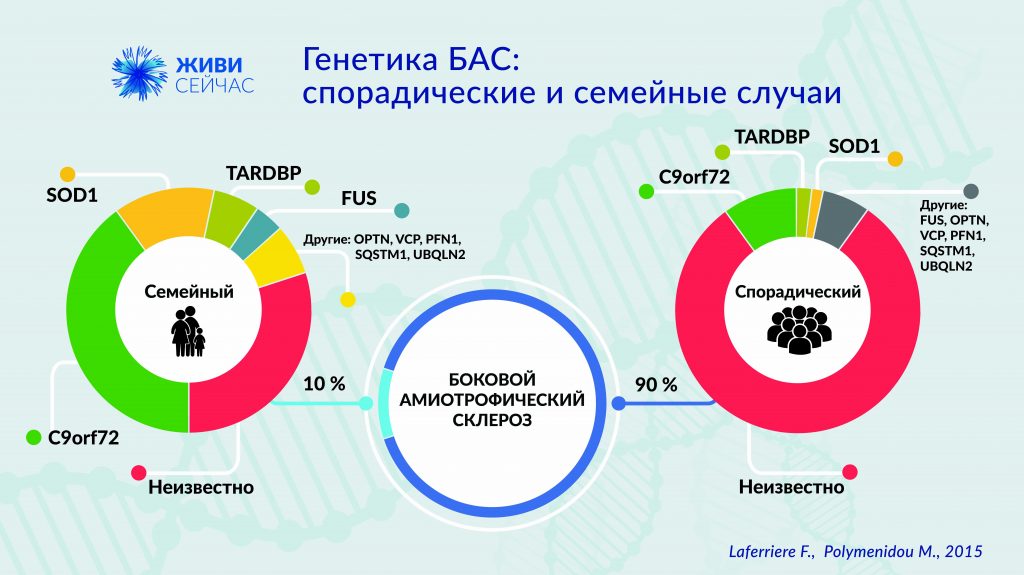
Семейная форма БАС как следствие генетических мутаций наблюдается в 10—15% случаев, однако этиология (причины и условия возникновения) остальных 90—85% случаев заболевания остается неизвестной. Установлено, что мутации в таких генах как SOD1, TARDBP, FUS, OPTN, VCP, UBQLN2, C9orf72 и TBK1 влияют на развитие заболевания.
Мутации в гене супероксиддисмутазы 1 (SOD1)
Мутации в гене SOD1 были первыми выявленными мутациями, которые способствуют развитию БАС. Они наблюдаются в 15—20 % случаев семейного и в 3 % случаев спорадического БАС.
Ген SOD1 расположен в хромосоме 21q22.11 и кодирует мономерный белок SOD1, состоящий из 153 аминокислот общей молекулярной массой в 16 килодальтонов (кДа). SOD1 уничтожает свободные радикалы супероксида, преобразуя их в молекулярный кислород О2 и H2O2. Описано около 180 мутаций этого гена, и только часть из них является патогенными. В основном, фермент SOD1 находится в цитоплазме, но также присутствует в лизосомах, клеточном ядре и митохондриях. D90A, A4V и G93A — наиболее частые мутации гена SOD1. Замена глицина в кодоне 93 на аланин (G93A) — самая редкая из них, но наиболее изученная.
G93A была первой мутацией, изученной на модели трансгенных мышей, которая, как было показано, вызывала синдром двигательного нейрона. Она может быть унаследована как доминантный или рецессивный признак, однако в большинстве случаев — это рецессивное наследование.
Мутации в SOD1 приводят к накоплению патогенного белка SOD1, нарушая его функцию, в результате чего активные формы кислорода (АФК) аккумулируются в митохондриях, что вызывает впоследствии их повреждение и гибель нейронов.
Мутации в TARDBP
TAR ДНК-связывающий белок молекулярной массой в 43 килодальтона (TDP-43) – это трансактивирующий белок клеточного ядра. Он – главная составляющая нейрональных цитоплазматических включений при спорадическом БАС. Мутации в гене TAR ДНК-связывающего белка (TARDBP) встречаются у довольно небольшого числа пациентов с БАС: 4 % случаев при семейной форме и 1 % – при спорадической.
TDP 43 и белок FUS (Fused in sarcoma) являются РНК-связывающими белками, которые в случае мутации меняют свое местоположение, перемещаясь из ядра в цитоплазму клетки. Одним из вероятных механизмов их патологического действия является нарушение нормальной функции процессинга целевых РНК из-за образования неблагоприятных прионоподобных участков, которые оба белка содержат в своей структуре.
Считается, что TDP43 регулирует процесс переноса информации с ДНК на РНК. При БАС наблюдается снижение уровней нормально функционирующего белка TDP43. Это нарушает метаболизм РНК и ведет к скоплению белковых агрегатов в цитозоле, обладающих нейротоксичностью.
Мутации в C9orf72
Экспансия гексануклеотидных повторов (GGGGCC) в первом интроне гена C9orf72 связана с патогенным механизмом двух заболеваний: семейной формы БАС и лобно-височной деменцией (ЛВД). Мутации в C9orf72 обнаружены примерно в 5 % всех случаев спорадического БАС и 30 % – семейного, что делает их наиболее значимыми в патогенезе БАС.
Кроме того, эту мутацию выявили у 25 % пациентов, у которых течению семейной формы БАС сопутствует ЛВД. Это подчеркивает важность гипотезы о том, что БАС и ЛВД – это крайние точки спектра проявлений одной и той же мутации.
В норме количество повторов нуклеотида составляет от 2 до 30, в то время как у людей с БАС таких повторов может быть от ста до нескольких тысяч на человека. Наследование этой мутации является аутосомно-доминантным. Общая генетическая причина семейного типа БАС и лобно-височной деменции была предложена в 1991 после анализа сцепления генов (совместного наследования генов, расположенных на одной хромосоме). Также проведение полногеномного поиска ассоциаций (GWAS) указало на общий генетический фактор, расположенный в хромосомной области 9p21.2.
У пациентов с мутацией в C9orf72 чаще наблюдается бульбарный дебют БАС. К сожалению, неясно, характерно ли это для других заболеваний, связанных с C9orf72. Более чем у 50 % пациентов с БАС при мутациях C9orf72 и TDP43 также наблюдалась деменция, нарушение исполнительных функций, когнитивные нарушения. У пациентов с мутацией в гене C9orf72 заболевание отличается более ранним дебютом и меньшим временем выживания, чем у остальных.
Мутация TBK1
TANK-связывающая киназа 1 (TBK1) – это открытый в 2013 году ген с четырьмя доменами: домен димеризации альфа-спиральной конформации (SDD), киназный домен (KD), убиквитин-подобный домен и С-концевой домен.
Киназный домен отвечает за кинетическую активность и взаимодействует с доменом SDD. Тот в свою очередь взаимодействует с убиквитин-подобным и С-концевым доменами. Благодаря их взаимодействию TBK1 может связываться с такими белками, как оптонейрин, который играет роль в аутофагии.
Белок TBK1 – многофункциональная киназа, которая усиливает функции ряда белков, задействованных в механизме врожденного иммунитета и аутофагии, включая оптонейрин (OPTN) и p62, которые вовлечены в процесс развития БАС. Также TBK1 участвует в клеточном росте, пролиферации и уничтожении бактерий.
Встречаются два вида мутаций в TBK1: мутация с потерей функции, вызывающая нарушение взаимодействия белка с белками-адаптерами, и миссенс-мутация (замена одного нуклеотида на другой), снижающая количество синтезируемого белка.
Группа ученых выявила, что миссенс-мутации у пациентов с БАС/ЛВД встречаются чаще, чем мутации с потерей функции. Кроме того, оба типа мутаций встречаются чаще у пациентов-европейцев, чем у азиатов. Исследователи предположили, что БАС вероятнее развивается не только в результате мутаций в TBK1, но и другого, пока не выявленного, механизма патогенеза.
Благодарим за помощь в переводе Дарину Обухову.
Продолжение. Начало — в материале «БАС: факторы риска и методы лечения».

