ДНК-диагностика: всем ли пациентам с БАС нужен генетический анализ?

Анализ каких генов делать при семейной и спорадической формах БАС в первую очередь? Что такое мутация de novo, и как она появляется в родословной? Если мутантных генов у болеющего БАС не обнаружено, что это значит? Публикуем доклад биолога, руководителя Лаборатории клинической биоинформатики, к.б.н. Федора Коновалова на Пятой общероссийской пациентской конференции по БАС с международным участием.
Важно помнить, что ген это не просто носитель информации, а совершенно конкретное физическое место в ДНК. Поэтому все гены, о которых пойдет речь, это определенные участки генома, которые можно химически в лаборатории выявить и узнать, что с ними не так.
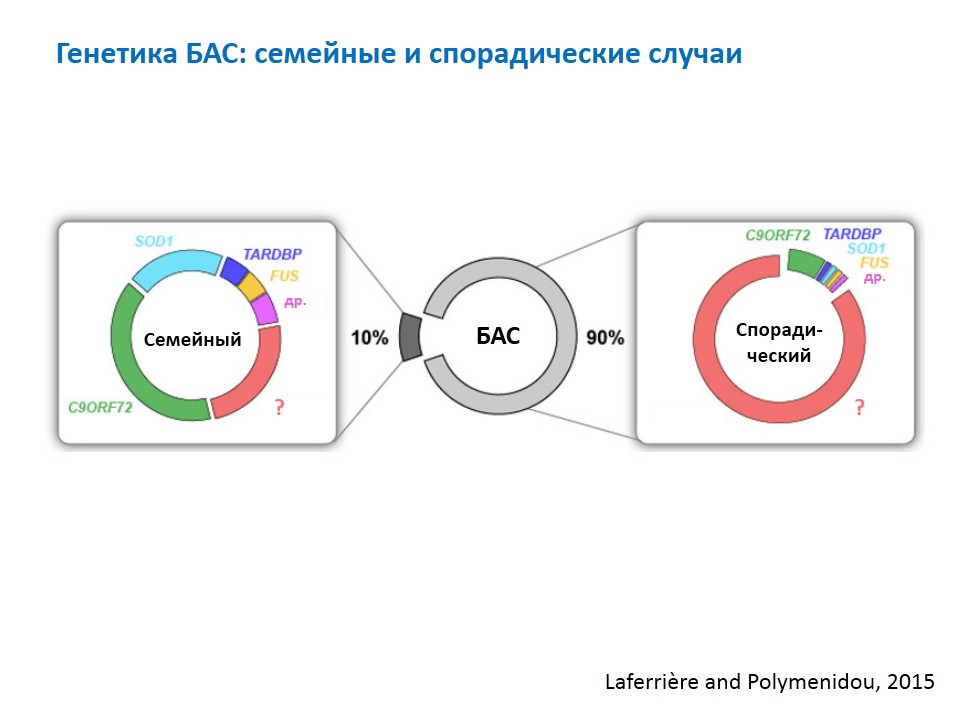
Когда речь идет о генетике БАС имеются в виду, конечно, семейные случаи, которых около 10%. При семейном БАС основной тип наследования — аутосомно-доминантный: это прямая передача потомкам без перескока через поколение с вероятностью 50% от больных к больным. Причем это не зависит от пола: мальчики и девочки болеют с одинаковой частотой. Откуда берутся эти 50%?!
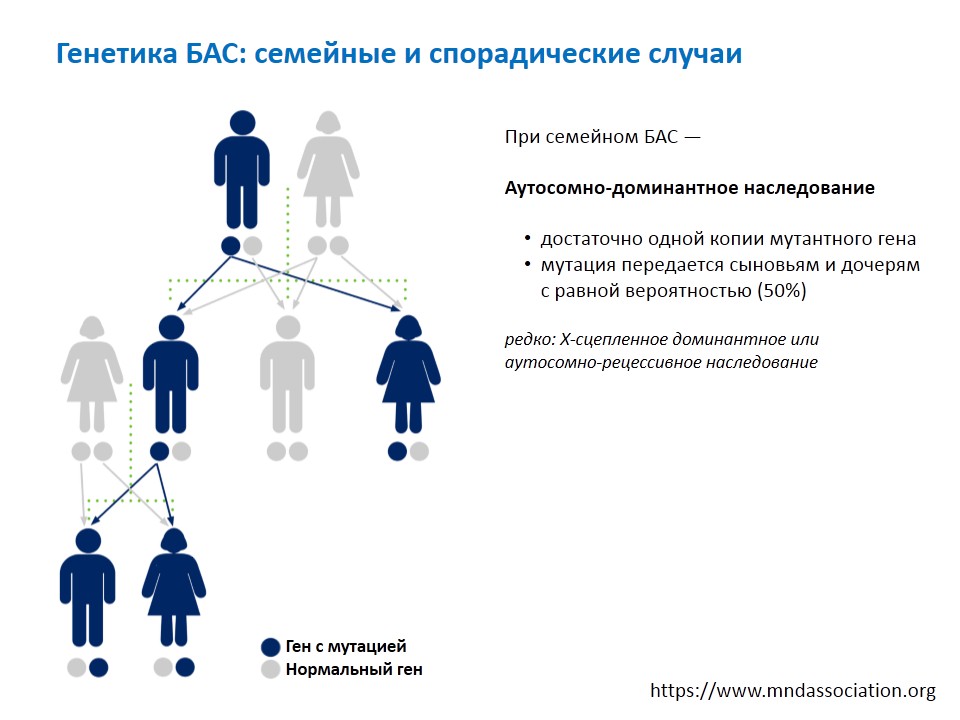
У больного в одной из хромосом — а мы помним, что их у нас по две — есть мутантный ген. Вторая такая же хромосома — нормальная. Каждому ребенку родитель передает только одну из каждой пары хромосом. Поэтому и получается, что больной с определенной вероятностью 50% на 50% передаст дефектную хромосому любому из потомков. Что здесь важно?! Допустим, что у больного два ребенка. Это не значит, что один ребенок унаследовал мутацию, а второй нет: вероятность 50% для каждого из детей равноценна и не зависит от того, есть уже в семье ребенок с мутантным геном или нет. При этом мутация передается с равной вероятностью сыновьям и дочерям больных. Крайне редко, но бывают Х-сцепленные доминантные рецессивные наследования. В таких случаях принцип передачи генов немного отличается. Его в рамках доклада мы рассматривать не будем.
Как появляется мутация в родословной
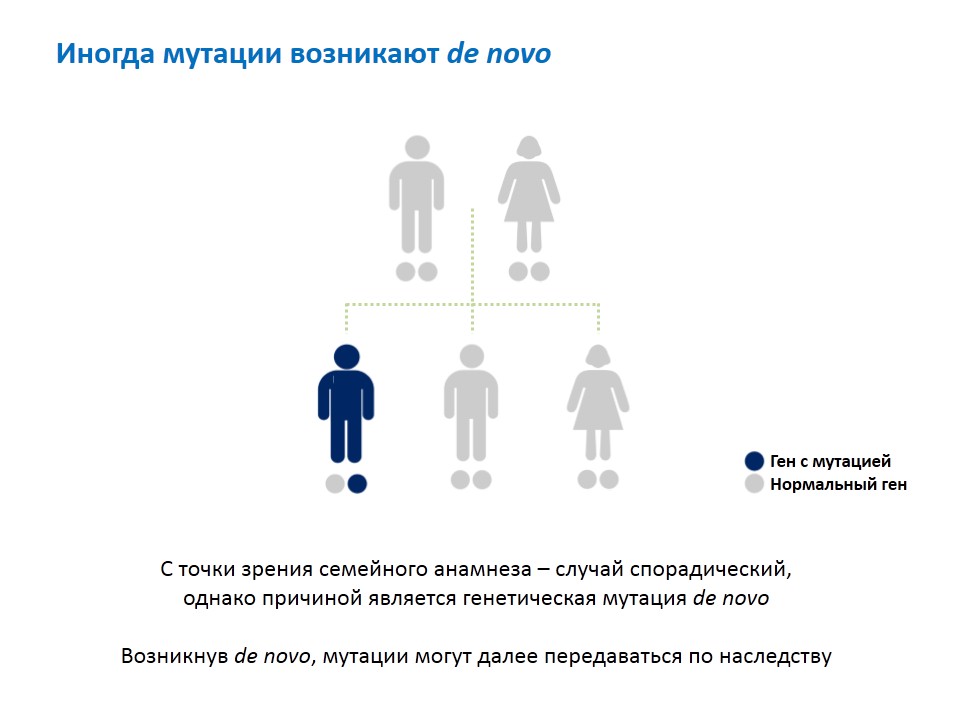
Иногда изменения в гене возникают de novo (де ново). Например, в семье, где оба родителя здоровые, у ребенка во взрослом возрасте развивается БАС. С точки зрения врача и самого пациента при изучении его семейного анамнеза (совокупности сведений о больном и его заболевании — здесь и далее прим. ред.) случай носит спорадический характер. Но де-факто он имеет наследственную причину: мутация появилась либо в ходе эмбриогенеза (процесс образования и развития эмбриона) этого человека при копировании генетической информации, либо при формировании половых клеток у родителей. Такое встречается чаще, при этом самих родителей и даже их последующих детей болезнь нисколько не затрагивает. Важно, что когда произошли такие мутантные изменения в гене, они будут передаваться по наследству, и спорадический БАС становится семейным. Такие случаи происходят с определенной частотой, которая соответствует как минимум той доле случаев, где установлена спорадическая форма заболевания.
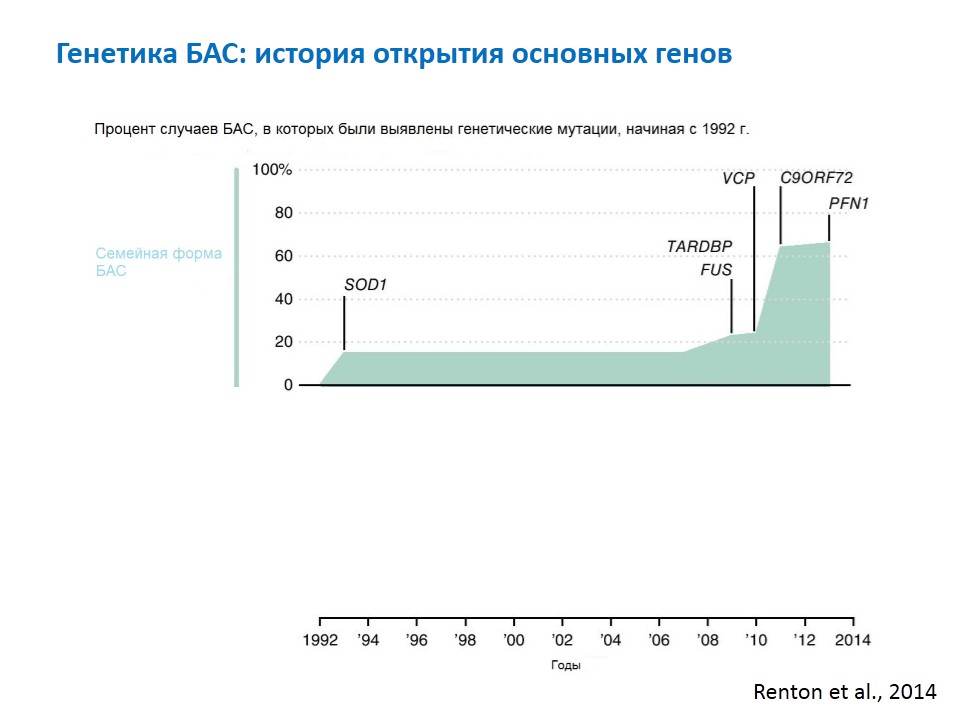
Какие гены вызывают БАС
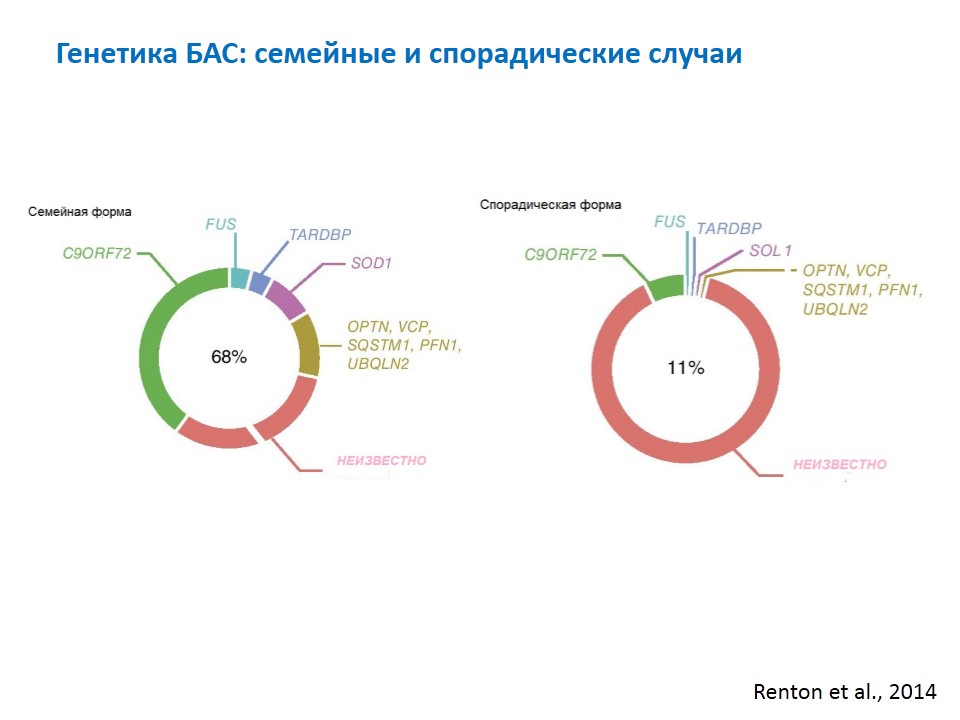
Первым открыли ген SOD1, который до сих считается одним из главных в развитии семейной формы БАС. Затем на протяжении многих лет открытий в этой области не было, и лишь в 2010-е годы случился их резких всплеск. В генетике появились новые технологии анализа ДНК, которые сейчас активно используются. Самый большой вклад внесло открытие гена C9orf72: сегодня генетическую причину семейной формы БАС удается выявить в 60—70% случаев.
Все остальные гены при семейном БАС составляют в сумме меньше, чем два вышеуказанных.
Что же со спорадической формой? Здесь на страже тоже генетика: мутация de novo возникает в тех же самых генах, которые люди могут унаследовать от больных родителей. Единственное исключение — ген SOD1, в котором выявляются как и мутации de novo в спорадических случаях, так и унаследованные, но не проявившиеся у родителей мутации. Это явление называется неполной пенетрантностью, когда при наличии мутантного гена заболевание не всегда развивается.
При доминантном типе наследования спорадическая форма БАС при анализе гена SOD1 выявляется примерно в 10% случаев. При этом в российской популяции он превалирует над геном C9orf72: при анализе последнего спорадическая форма выявляется гораздо реже, чем при SOD1.
Всего известно примерно 20 генов, мутантные изменения в которых так или иначе вызывают БАС.
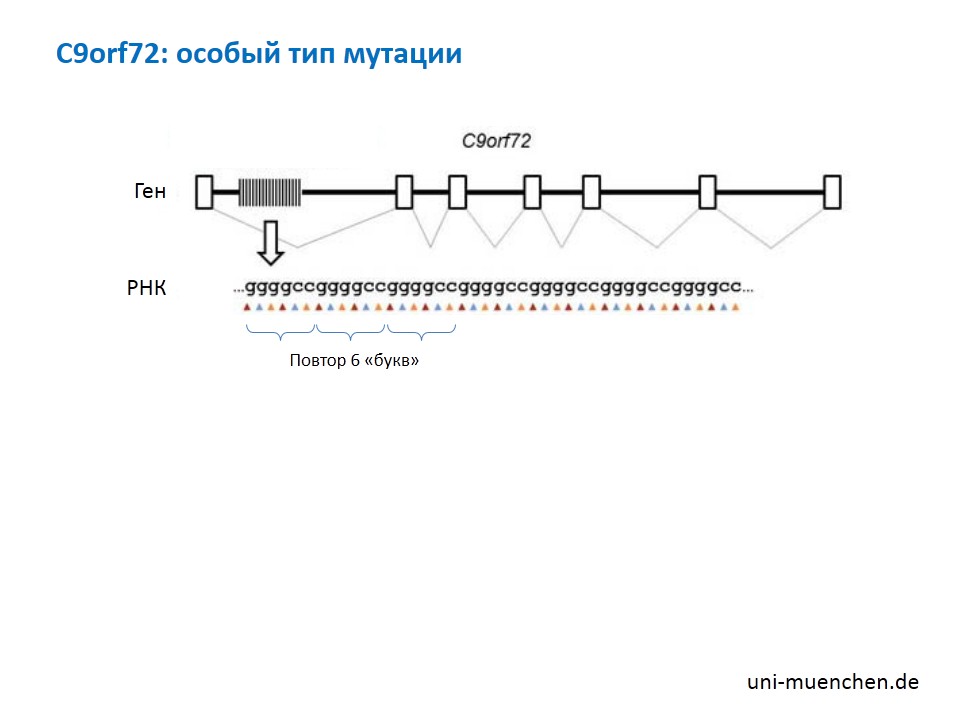
О чем ещё нужно знать? Ген C9orf72. Это не только один из главных генов при семейном типе БАС. Мутантные изменения в нем совершенно отличаются от других. А от этого зависит какой генетический тест лучше сдать. В гене C9orf72 мутация представляет собой изменение числа повторов вне кодирующего участка гена. Если в ДНК такие повторы, состоящие из шести одинаковых букв 4g2с4g2c, превышают определенный уровень, то вероятность развития заболевания повышается многократно. У здоровых людей такие повторов насчитывается до 24-х. Если повторов 60–80, то такая мутация может привести либо к БАС либо к лобно-височной деменции или БАС с лобно-височной деменцией. Поэтому генетический анализ проводится не просто на наличие какого-то сбоя в ДНК, а на подсчет количества повторов. Именно этим и отличается данная мутацию от всех остальных, которые устроены гораздо проще.
Проводить или не проводить генетическое тестирование
В первую очередь, надо ответить на вопрос: для кого? Для пациента с БАС — понятно, что это уточнение диагноза и прогноза при наличии заболевания. Зная молекулярную причину, врач знает с чем это сопоставить в литературе, с мировым опытом. Назначенное лечение, например, при конкретной форме БАС может быть скорректировано. В частности, для БАС, вызванного мутациями в гене C9orf72, существуют определенные разработки патогенетической терапии (устранения и подавления механизмов развития болезни).
Нужно ли проверять всех членов семьи и ДНК-анализом подтверждать наследование мутантных генов? Даже при семейной форме БАС нужно знать в каком гене болеющего родственника есть мутация. Сдавать ДНК-анализ наобум или делать широкий поисковый тест за 50 тысяч рублей всем членам семьи – глупо. Тестирование родственников должно проводиться прицельно.
То же касается и вопроса о планировании семьи. Если, например, вы хотите обеспечить рождение детей гарантированно без БАС с помощью ЭКО и прибегаете к преимплантационной генетической диагностике (выявление заболеваний у эмбриона перед имплантацией в матку, сокращенно – ПГД), то вам нужно знать какой мутантный ген обнаружен у болеющего. ПГД не делается на поиск болезни: причина должна быть выявлена до того, как планировать ЭКО.
Очевидно, что для тех, кто является родственником при семейном БАС, необходимость тестирования – это возможность знать будет ли болезнь. Этот вопрос каждый взрослый человек решает сам для себя.
Если же речь идет о здоровых людях, которые еще не знают будет ли у них заболевание, то нужно понимать, что возможен существенный психологической эффект от результатов исследования. Генетические анализы имеют одно очень важное свойство: они делаются раз и навсегда, это путь в одну сторону. В отличие, например, от МРТ или биохимических анализов, которые отслеживают динамику. Поэтому перед тем, как делать любое генетическое исследование – и речь здесь не только о БАС – нужно хорошо подумать.
Методы анализа ДНК
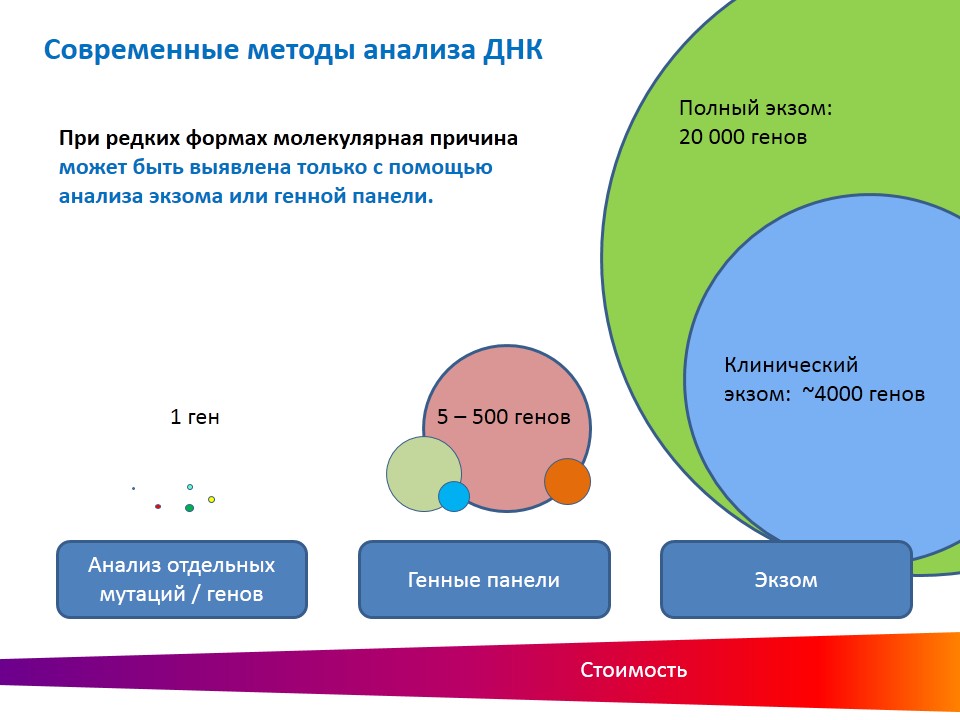
Современные методы анализа ДНК позволяют читать сразу десятки и сотни генов в рамках одного исследования за разумные деньги. Доступны для анализа даже так называемые «полные экзомы» (полноэкзомное секвенирование ДНК) – кодирующие участки всех 20 000 генов человека, или его клинически значимую часть (около 4000 генов). Такой анализ помогает при редких формах БАС, когда, за исключением генов SOD1 и C9orf72, молекулярная причина может быть установлена только через анализ экзома или генной панели. Естественно, стоимость анализа возрастает, но оно не пропорционально увеличению объема исследования. Поэтому, в особых случаях, оправданны.
Генетические тесты можно разделить по их принципу. Поисковые — когда в определенном месте генома мы ищем любые мутации. Подтверждающие тесты — это когда мы в ДНК ищем конкретную мутацию. Например, анализ повтора в гене C9orf72. Тест делается специальными наборами и не входит ни в одно другое исследование, даже в дорогостоящие полногеномные. Тест на поиск мутаций в гене C9orf72 всегда нужно делать отдельно. По стоимости он доступен большинству.

То же и анализом гена SOD1. Его ещё можно назвать комбинированным. Почему? Тест проводится классическим методом секвенирования по Сэнгеру, доказавшим свою эффективность. Это подтверждающий тест одновременно с поиском мутации. Его стоимость чуть выше теста гена C9orf72, но в пределах разумного.
Тест на анализ вышеуказанных генов имеет смысл делать при обеих генетических формах БАС. Только при семейном БАС в первую очередь лучше начинать с анализа гена C9orf72, а при спорадической форме — SOD1. Можно сразу оба сделать: зависит от возможностей.
Если в этих двух исследованиях ничего не было найдено, то тогда можно переходить к более масштабным — полноэкзомному секвенированию или генным панелям «Нейродегенеративные заболевания». Их проводит ряд лабораторий, которые владеют современным методом секвенирования нового поколения. Какая именно генная панель подойдет для пациента с БАС в лабораториях должны сообщать при первичном консультировании по телефону. Если лаборатория затрудняется ответить на этот вопрос, то, наверно, не стоит ей доверять, потому как организация должна знать, какие исследования проводит и какие услуги оказывает.
Любая генетическая панель ограничена известными генами. В ней могут отсутствовать гены, открытые совсем недавно. В таком случае можно делать секвенирование экзома. По стоимости исследование экзома ненамного превышает стоимость проведения генных панелей.
Если же делать анализ генома, куда, помимо кодирующих участков, входит всё остальное: межгенные участки, интроны и т. п., то его стоимость в два раза превышает стоимость анализа экзома, но сам анализ с точки зрения диагностической эффективности лишь на несколько процентов лучше. Анализ генома больше интересен для исследовательских целей. Он является последним этапом генетической диагностики.
Последние два метода объединяются в группу NGS – секвенирование нового поколения. Несмотря на это, их результаты нужно подтверждать. Когда найдена мутация с помощью панелей, секвенирования экзомов и геномов, врач подтвердил причину, нужно подтверждать конкретную мутацию секвенированием по Сэнгеру. Допустим, секвенировали вы экзом, нашли там мутацию НЭК1, нужно подтвердить ее наличие другим методом — классическим и надежным, таким как метод Сэнгера. Будет проведен тест конкретно выявленной мутации, а не всего экзома.
Вопросы из зала
Если больной сдает первые два анализа, БАС подтверждается, стоит ли родственникам тоже сдать эти анализы?
Коновалов Ф. А.: Решение принимает сам родственник. Родственники сдают уже анализ на то, где что-то найдено. Если найдена мутация в гене C9orf72, то надо сдавать только на поиск мутаций в C9orf72. Если у больного найдет SOD1, то родственник сдает только SOD1. Лишние ДНК-анализы родственникам сдавать не нужно.
Важный момент: каким может быть результат генетического теста. С одной стороны, есть классический «плюс»: выявлена известная патогенная мутация. Например, при анализе C9orf72 выявлено больше сотни повторов, а при анализе SOD1 — классическая 91-я мутация. Вроде, все понятно, нашли причину, но не нужно из этого ставить знак равенства в отношении развития заболевания, если тестируется родственник. Вероятность развития БАС и прогноз течения заболевания зависит не от самого факта результата, а от гена, особенно это касается SOD1 и конкретной мутации. Даже в пределах одного гена некоторые мутации иногда дают разный эффект. И хорошо, если этот эффект описан в литературе на большой когорте пациентов, тогда всё можно сопоставить. А иногда бывает, что нет. Здесь всегда нужно давать определенный запас на вариабельность проявлений даже мутации в одном и том же гене.
Если, допустим, проверили мужа, у которого БАС, на SOD1 и C9orf72, мутаций выявлено не было. Значит ли это, что дети унаследуют БАС, надо ли их проверять?
Коновалов Ф. А.: Нет, не факт, что это наследственное. Поскольку результата положительного, по молекулярной причине, пока нет и в семье это первый случай, то это может быть спорадический случай. Для детей это будет иметь актуальность, если такая причина будет найдена. Если это действительно спорадический случай, то БАС на нем закончится. Потому что это не генетическая причина. Если же это на самом деле наследственная причина — мутация de novo —, тогда может не закончиться на муже, да. Здесь зависит от того, есть мутация или нет. Правильно, что сделали первые два теста сделали. Здесь еще по вашему клиническому случаю нужно смотреть.
Я болею БАС, у меня есть брат-близнец однояйцевый, ранее никто в семье не болел. У меня сын. Надо ли сдавать анализ ДНК?
Коновалов Ф. А.: Можно сдать анализ ДНК. Я не буду директивно говорить нужно это делать или нет, но анализ можно сделать взрослому человеку. Если случай спорадический, но за счет мутации, тогда — да, это будет иметь отношение к однояйцевому близнецу, если он не «мозаик» (когда клетки различаются по генетической конструкции). Кстати, им может быть и сам болеющий, и БАС будет только у него. И, возможно, дети унаследуют. Если же это не наследственный случай, то тогда БАС не будет иметь отношение больше ни к кому в семье.
При генетическом анализе надо учитывать еще один момент: промежуточный вариант этих тестов. Поисковые исследования потому так и называются, потому они такие сложные и современные, что иногда выявляют мутации, которые ранее никем в мире не были описаны. Это не делает эти мутации плохими, но мы их вынуждены «вариант с неопределенной значимостью», есть такой термин. Что это значит? Эти мутации являются либо патогенными либо ни на что не влияющими. Мы просто не знаем это до конца. По международным стандартам их рекомендовано все равно сообщать. Чтобы выяснить патогенная мутация или нет, могут потребоваться дополнительные исследования, например, анализ ДНК родителей. Тогда можно подтвердить, например, статус de novo, если у родителей мутации нет, а у потомка есть. С учетом возраста манифестации БАС это не всегда возможно. Нужны научные эксперименты, функциональный анализ мутации, который не всегда возможен. К сожалению, некоторые результаты таких поисковых исследований так и остаются в неопределенном статусе. Такова реальность. Для болеющего такие варианты не повод делать выводы ни в плюс, ни в минус.
И наконец, отрицательный результат, когда мутации не выявлены. Во-первых, это ни в коем случае не исключает клинический диагноз. Если врач поставил БАС, а в генах мутации не обнаружено, это не означает, что болезни нет. Это важно. Почему результат может быть отрицательным?
Первая причина — конкретный случай БАС не является наследственным. Он истинно спорадический и не имеет генетической причины. Вторая причина — мутация есть, но она в каком-то новом, еще не открытом гене. Все гены, которые сейчас нам известны, были когда-то в неопределенном статусе. Еще несколько лет назад мутацию в НЭК1, найдя даже ее в экзоме, нельзя было сообщить и интерпретировать. И самый коварный момент: мутация может быть и есть в геноме, но она не выявилась из-за технических ограничений метода.
Скажите, пожалуйста, известны ли причины спорадических мутаций науке или нет. Из-за чего это возникает? Есть причины?
Коновалов Ф. А.: Каждый из нас является носителем каких-то мутаций, в том числе de novo. У каждого — в среднем 80 отличий, которые есть только у нас, а у наших родителей нет. У большинства они случайным образом не попадают в какие-то значимые участки генома. ДНК в каждой клетке и в каждом организме все время копируется все время. Этот процесс не идеален: копирование подвержено ошибкам. Для этого нет никакой внешней причины. Естественно, бывают такие сильные мутагенные воздействия, если живешь, например, в зоне радиационного облучения. Естественный мутагенный фон на самом деле не так сильно влияет на частоту мутации de novo. Поэтому точную причину назвать затрудняюсь.
Когда, с Вашей точки зрения, можно надеяться на переход от простой констатации факта, что мутации такого-то гена приводят к БАС, к пониманию механизма почему это происходит? Как Вы думаете, когда это может быть?
Коновалов Ф. А.: Здесь нет такой точной даты. Такие механизмы ученые будут постепенно открывать для каждого гена в отдельности. Потому что механизмы будут разными в этих случаях. Например, для мутации C9orf72 таких механизмов уже предложено как минимум четыре. Данные есть в пользу всех. Исследования ведутся чрезвычайно активно. Думаю, в ближайшие 10 лет, какие-то новые механизмы тоже появятся, а в ближайшие 20—25 лет будет уже известно их существенное количество.

Благодарим за помощь в расшифровке видеозаписи доклада конференции волонтера БФ «Живи сейчас» Елену Петросян.

